经过四年多的努力,药学院毛新良教授和多个团队通力合作,采用亲和纯化偶联蛋白组学策略,成功解析了多发性骨髓瘤中困扰已久的难题,阐明了癌转录因子c-Maf发生泛素化降解的关键调控机制,为多发性骨髓瘤的治疗指明了新的靶标。该研究成果《The ubiquitin ligase HERC4 mediates c-Maf ubiquitination and delays the growth of multiple myeloma xenografts in nude mice》最近在国际著名专业期刊《血液学》(Blood)在线发表(Blood. 2016 Jan 29. pii: blood-2015-07- 658203)。
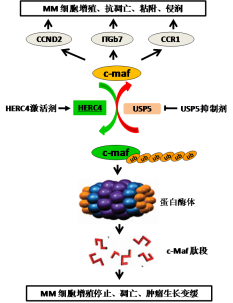
毛新良教授团队一直致力于这些Maf蛋白的研究,以期找到基于Maf蛋白的治疗多发性骨髓瘤的药物。由于纠正染色体易位是非常困难的,因此,能否通过诱导Maf蛋白质降解而尽可能消除它们的癌症促进作用呢?在药物筛选工程中,毛教授等发现其实一些抗多发性骨髓瘤的药物,例如地塞米松等就可以通过诱导c-Maf的降解而促进癌细胞的死亡(Mao X et al., Blood, 2007)。由于Maf蛋白质在降解之前需要连接上一个叫做泛素的标签,这样的话细胞内的蛋白质降解机制就能识别这些蛋白质并使之降解。而这种标签要连到Maf蛋白质上需要细胞内不同蛋白质(蛋白泛素化酶)的协同作用。经过缜密的实验设计、多次的实验条件优化,最终通过串联质谱技术发现了与c-Maf蛋白泛素化的相关酶,包括c-Maf泛素化的特异性连接酶HERC4和去泛素化酶USP5。 HERC4 特异性地介导c-Maf的泛素化和随后的蛋白酶体降解,因而在多发性骨髓瘤的发生过程中表现为一个抑癌蛋白,能够抑制多发性骨髓瘤细胞的增殖、诱导细胞周期停滞和癌细胞的最终死亡。而USP5使HERC4介导的泛素化去除,增强c-Maf的稳定性。因此作者推断HERC4和USP5精密调控c-Maf的泛素化和稳定性。该成果对深入理解多发性骨髓瘤的发生机制和开发多发性骨髓瘤的精准治疗治疗药物提供了坚实的基础。
论文链接:http://www.ncbi.nlm.nih.gov/pubmed/26825710

